
2021年中考化学二轮复习第4讲-溶液的配制
考点一溶液的浓度1.溶质质量分数


 考点二配制一定溶质质量分数的溶液1.仪器的选用及各仪器的作用(1)所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、量筒、胶头滴管、烧杯、玻璃棒。 (2)玻璃棒的作用:搅拌,加快固体或液体溶质的溶解速率。 (3)量筒的作用:量取液体的体积。选取量筒时量程要比量取液体的体积略大,且越接近越好。
考点二配制一定溶质质量分数的溶液1.仪器的选用及各仪器的作用(1)所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、量筒、胶头滴管、烧杯、玻璃棒。 (2)玻璃棒的作用:搅拌,加快固体或液体溶质的溶解速率。 (3)量筒的作用:量取液体的体积。选取量筒时量程要比量取液体的体积略大,且越接近越好。
 3.注意事项(1)托盘天平的使用:用托盘天平称量时要遵循“左物右码”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量。 (2)量筒的使用①用量筒量取液体,读数时视线应与量筒内液体凹液面的最低处相平。 ②选取量筒的量程要比所要量取液体体积稍大且越接近越好。
3.注意事项(1)托盘天平的使用:用托盘天平称量时要遵循“左物右码”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量。 (2)量筒的使用①用量筒量取液体,读数时视线应与量筒内液体凹液面的最低处相平。 ②选取量筒的量程要比所要量取液体体积稍大且越接近越好。

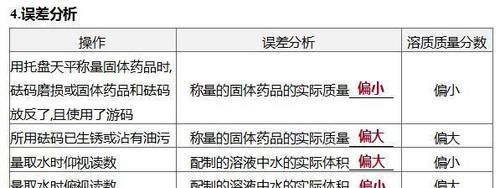
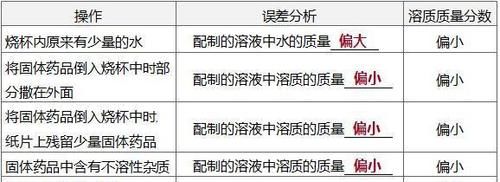
 5.用浓溶液配制一定溶质质量分数的溶液(1)操作步骤①计算:计算所需浓溶液的体积和所需水的体积。 ②量取:用量筒(很接近所需体积时改用胶头滴管)量取浓溶液和水。 ③稀释:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。 (2)误差分析①溶质质量分数偏小:量取水的体积时仰视读数,烧杯中原来有少量水,稀释过程中有浓溶液溅出等。②溶质质量分数偏大:量取水时俯视读数等。
5.用浓溶液配制一定溶质质量分数的溶液(1)操作步骤①计算:计算所需浓溶液的体积和所需水的体积。 ②量取:用量筒(很接近所需体积时改用胶头滴管)量取浓溶液和水。 ③稀释:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。 (2)误差分析①溶质质量分数偏小:量取水的体积时仰视读数,烧杯中原来有少量水,稀释过程中有浓溶液溅出等。②溶质质量分数偏大:量取水时俯视读数等。
 考向一有关溶质质量分数的计算1. [2019·杭州]如图4-2所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是 A.在①→②过程中,氯化钠的质量分数保持不变B.在②→③过程中,氯化钠的溶解度不断增大C.在③→④过程中,水的质量分数不断增大D.在②→④过程中,氯化钠的质量分数先不变后增大
[解析] ①→②过程中恒温蒸发,水的质量不断减小,氯化钠的溶质质量分数不断增大;②→③过程中由于是恒温蒸发,故物质的溶解度保持不变;③→④为升温蒸发过程,溶解度变大,饱和溶液中溶质质量分数逐渐增大,故水的质量分数不断减小;②→③为恒温蒸发过程,②溶液恰好为饱和状态,故②→③过程中溶质质量分数不变,③→④为升温蒸发过程,氯化钠溶解度变大,故③→④过程中溶质质量分数逐渐增大。
考向一有关溶质质量分数的计算1. [2019·杭州]如图4-2所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是 A.在①→②过程中,氯化钠的质量分数保持不变B.在②→③过程中,氯化钠的溶解度不断增大C.在③→④过程中,水的质量分数不断增大D.在②→④过程中,氯化钠的质量分数先不变后增大
[解析] ①→②过程中恒温蒸发,水的质量不断减小,氯化钠的溶质质量分数不断增大;②→③过程中由于是恒温蒸发,故物质的溶解度保持不变;③→④为升温蒸发过程,溶解度变大,饱和溶液中溶质质量分数逐渐增大,故水的质量分数不断减小;②→③为恒温蒸发过程,②溶液恰好为饱和状态,故②→③过程中溶质质量分数不变,③→④为升温蒸发过程,氯化钠溶解度变大,故③→④过程中溶质质量分数逐渐增大。
 2. [2019·攀枝花节选]A、B、C三种固体物质的溶解度曲线如图4-3所示,回答下列问题。(1)t1 ℃时,C的饱和溶液的溶质质量分数为 。
2. [2019·攀枝花节选]A、B、C三种固体物质的溶解度曲线如图4-3所示,回答下列问题。(1)t1 ℃时,C的饱和溶液的溶质质量分数为 。
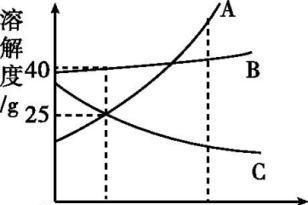
 (2)将t1 ℃的A、B、C三种饱和溶液分别升温至t2 ℃,所得溶液中溶质质量分数由大到小的顺序是。 [解析] (2)t1 ℃时,A、B、C三种物质的溶解度由大到小的顺序是B>A=C,故此时三种物质的饱和溶液中溶质质量分数大小关系为B>A=C;将t1 ℃A、B、C三种物质的饱和溶液分别升温到t2 ℃时,由于A、B物质的溶解度随温度升高而增大,因此A、B饱和溶液将变为不饱和溶液,其溶质质量分数不发生改变;C物质的溶解度随温度升高而减小,因此升温时C物质的饱和溶液将析出部分晶体变为t2 ℃时的饱和溶液,其溶质质量分数将减小;故此时三种物质的溶液中溶质质量分数由大到小的顺序为B>A>C。
(2)将t1 ℃的A、B、C三种饱和溶液分别升温至t2 ℃,所得溶液中溶质质量分数由大到小的顺序是。 [解析] (2)t1 ℃时,A、B、C三种物质的溶解度由大到小的顺序是B>A=C,故此时三种物质的饱和溶液中溶质质量分数大小关系为B>A=C;将t1 ℃A、B、C三种物质的饱和溶液分别升温到t2 ℃时,由于A、B物质的溶解度随温度升高而增大,因此A、B饱和溶液将变为不饱和溶液,其溶质质量分数不发生改变;C物质的溶解度随温度升高而减小,因此升温时C物质的饱和溶液将析出部分晶体变为t2 ℃时的饱和溶液,其溶质质量分数将减小;故此时三种物质的溶液中溶质质量分数由大到小的顺序为B>A>C。
 考向二有关溶液稀释问题的探究3. [2018·本溪]如图4-4是装有浓硫酸的试剂瓶的标签。请计算:(1)硫酸中硫元素和氧元素的质量比为(填最简整数比)。
考向二有关溶液稀释问题的探究3. [2018·本溪]如图4-4是装有浓硫酸的试剂瓶的标签。请计算:(1)硫酸中硫元素和氧元素的质量比为(填最简整数比)。
 (2)要把100 g该浓硫酸稀释为溶质质量分数为20%的硫酸,需要水的质量________g。 (2)设需要水的质量为x,则100g×98%=(100g+x)×20%,解得x=390g
(2)要把100 g该浓硫酸稀释为溶质质量分数为20%的硫酸,需要水的质量________g。 (2)设需要水的质量为x,则100g×98%=(100g+x)×20%,解得x=390g
 考向三溶质质量分数与化学方程式相结合的计算4. [2019·云南]某化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3 g纯铝片和40 g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g。试计算:(1)生成氢气的质量是g。 (2)所用氢氧化钠溶液的溶质质量分数。[提示:2Al+2NaOH+2H2O = 2NaAlO2 +3H2↑]
考向三溶质质量分数与化学方程式相结合的计算4. [2019·云南]某化学兴趣小组的同学到化学实验室,用铝和氢氧化钠溶液反应来制备氢气。同学们取了3 g纯铝片和40 g一定质量分数的氢氧化钠溶液,充分反应后,铝片有剩余,称得反应后剩余物质的总质量为42.7 g。试计算:(1)生成氢气的质量是g。 (2)所用氢氧化钠溶液的溶质质量分数。[提示:2Al+2NaOH+2H2O = 2NaAlO2 +3H2↑]















上一篇:高分必背:高中化学答题套路+必备解题技巧汇总
下一篇:没有了




