
《自然·化学》布里斯托大学:螺旋水凝胶丝基的
总结
人工细胞 -like 社区参与多种化学相互作用模式,但与当地环境的接触很少。最近,英国布里斯托尔大学博士。李梅/院士斯蒂芬·曼团队开发了一种基于固定一个一组具有酶活性的半透蛋白体在螺旋水凝胶内实现信号诱导运动。

团队< /span>将大的单个多核苷酸/肽微胶囊连接到螺旋原始细胞丝的一端或两端,以产生独立的软微致动器,可以感知和处理化学信号以执行机械工作。 不同的易位模式是通过位于螺旋连接器或附着的微胶囊负载中的协同或拮抗酶促反应实现的。
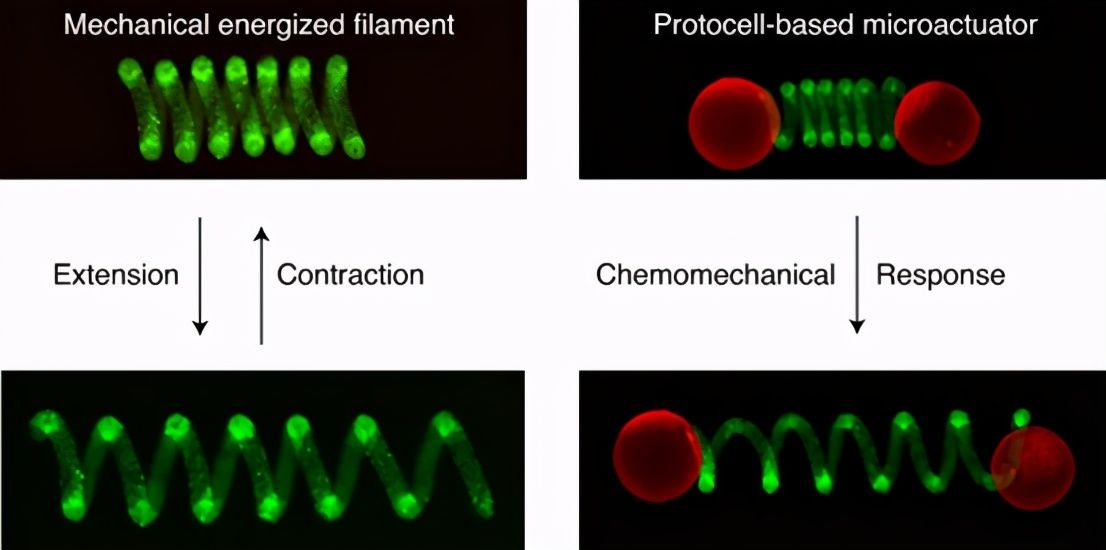
执行器安装在棘轮形表面上以产生定向推拉运动。这种方法为可以利用机械功的基于原始细胞的化学系统开辟了道路,是具有更高水平操作自主性的软和微型物体的工程设计的一步。相关论文以Chemical-mediated translocation in protocellbased microactuators Nature发表化学。
嵌入原始细胞的螺旋水凝胶丝的微流体制备
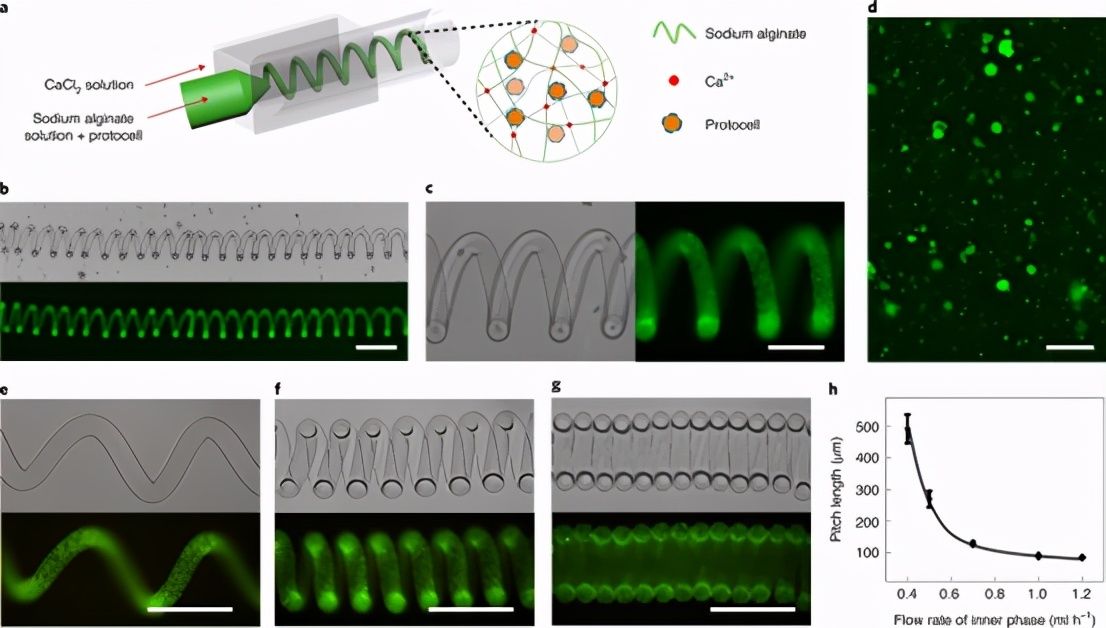
图 1:嵌入原始细胞的螺旋微流控制备水凝胶丝。
初级细胞介导的能量释放和螺旋延伸 < /p>
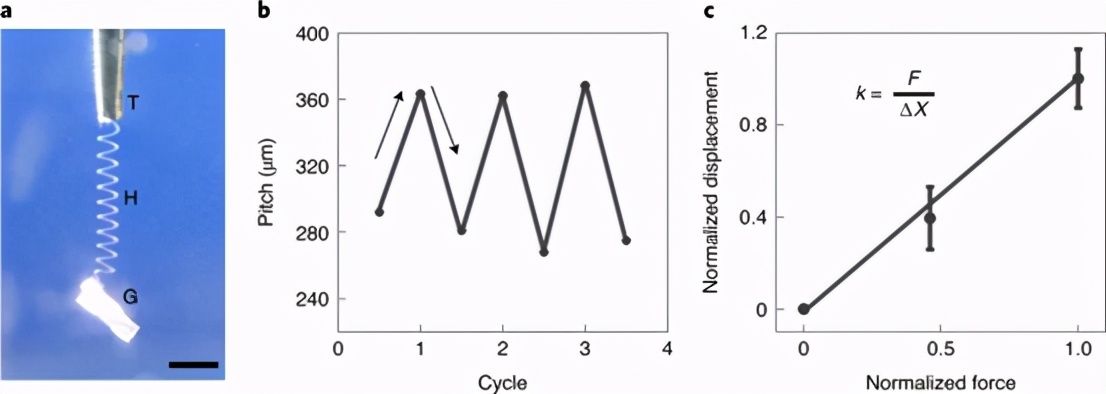
图 2:原始细胞调解灵活的行为.

< strong>图 3:原始细胞介导的能量释放和螺旋水凝胶长丝伸长。
原始细胞诱导拉伸的螺旋丝收缩 p>

图 4:原始细胞诱导的延伸螺旋 水凝胶细丝收缩。
确定螺旋的可逆伸缩< /span> p>
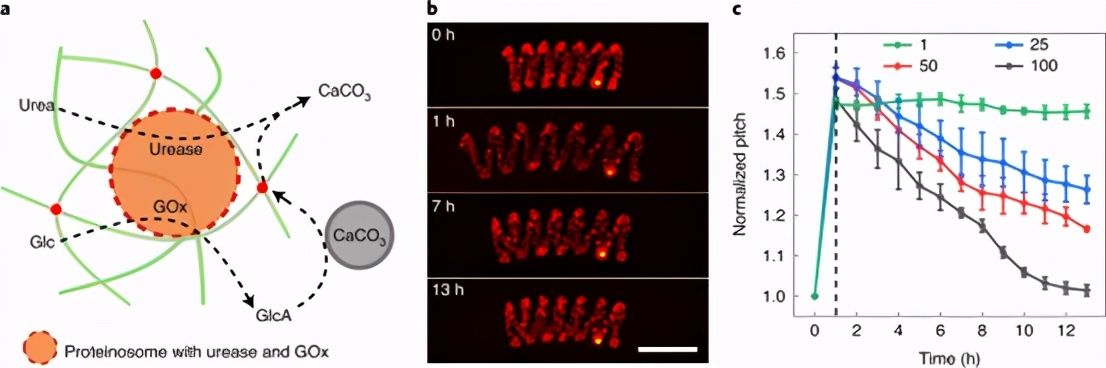
图 5:原始细胞-介导的螺旋水凝胶细丝可逆地收缩。
基于原始细胞的致动器中酶介导的易位
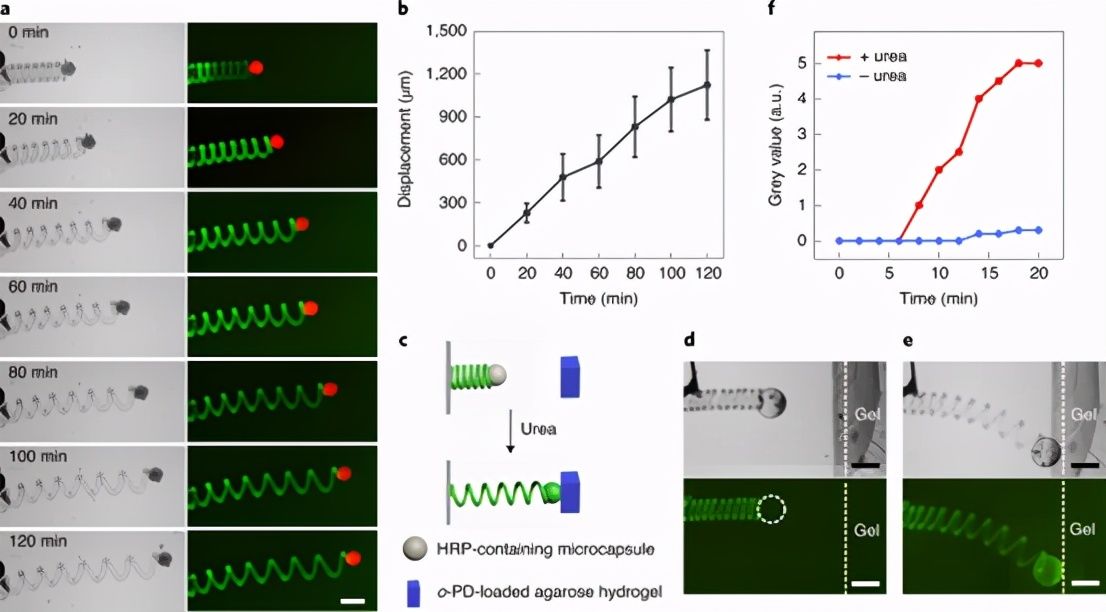
图 6:基于酶-介导的原始细胞微致动器易位。
基于原始细胞的独立微致动器的内在传输
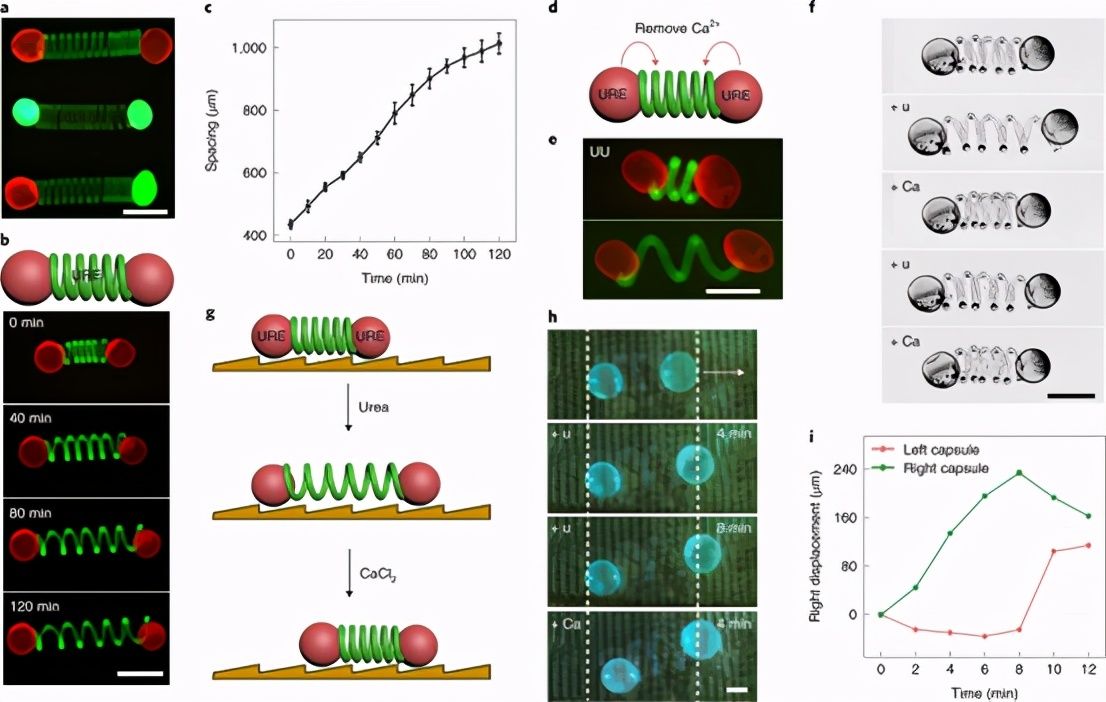
图 7:内源性传播基于原始细胞的微致动器。
基于上述方法,团队构建了一个集成的原始细胞操作 span>
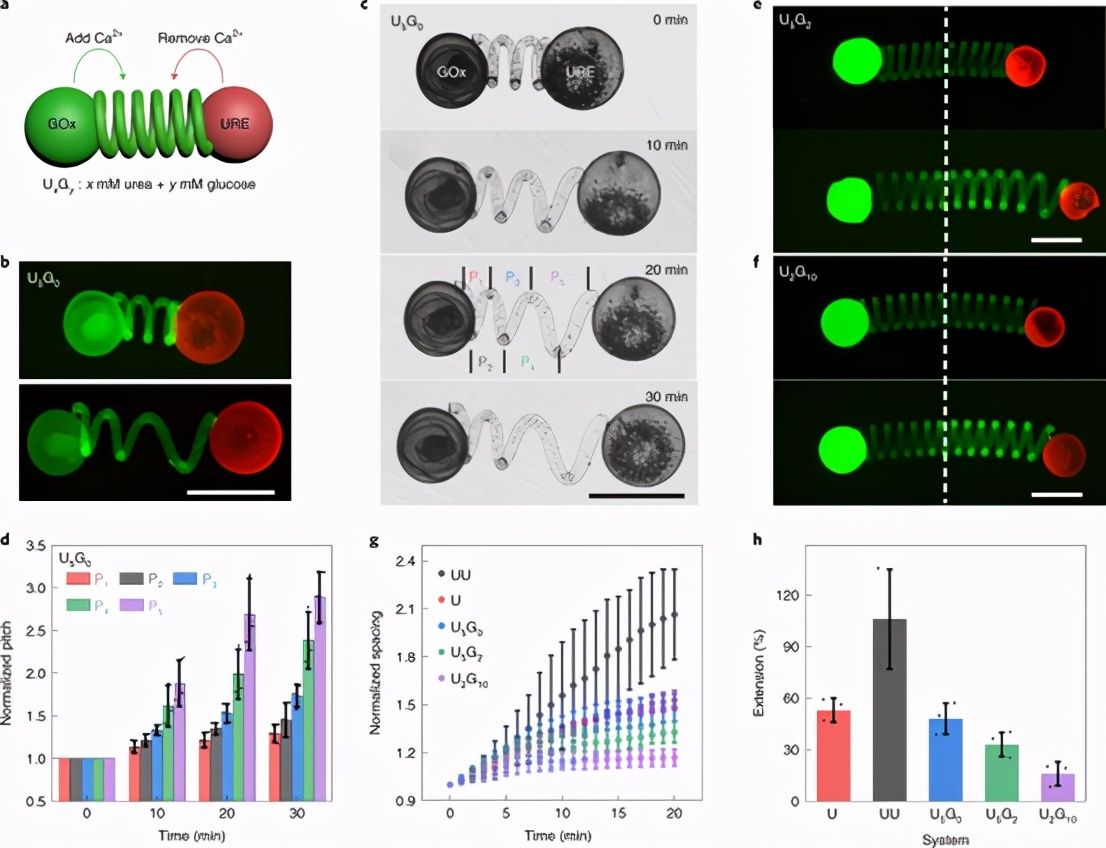
图8:基于细胞微致动器中的原始对抗传输模式。
总结
该结果显示了一种设计交互式原始细胞网络/环境系统的方法,这是使用固定微反应器进行可逆化学机械运动以及刺激软微材料的工程和内源性反应的一步。机会。
参考文献:
< p>doi.org/10.1038/s-021-00728-9上一篇:彩客化学(01986)6月28日斥5.37万港元回购4.1万股
下一篇:没有了




