
每日一点 | 初三化学:酸碱盐知识点梳理(二)
积土成山,积水成渊,学习贵在坚持,每日一点,每天多学一点点。酸碱盐是中考化学的必考点,近期唯唯会帮大家梳理这部分的基础知识点,可以结合自己所学复习下哦~
 第二部分 常见的碱1.定义:在水溶液中解离时产生的阴离子全部是氢氧根离子(或OH-)的化合物2.常见碱的特性及用途(1)氢氧化钠①化学式NaOH,俗称火碱、烧碱、苛性钠。白色固体;有强烈的腐蚀性,若沾在皮肤上,要用大量水冲洗,再涂上硼酸溶液;易溶于水,溶解时放出大量的热;易潮解,可用作某些气体的干燥剂②用途:用于生产肥皂以及石油、造纸、纺织和印染等工业;生活中用于除油污等(2)氢氧化钙①化学式Ca(OH)2,俗称熟石灰、消石灰。白色粉末状固体,微溶于水;溶解度随温度的升高而减小,有腐蚀性②用途:作建筑材料;保护树木,防止冻伤,并防止害虫生卵;用于改良酸性土壤、配制农药波尔多液等【注意】氢氧化钠、氢氧化钙易吸收空气中的CO2(或二氧化碳)而变质,因此需密封保存3.化学通性(碱4条)与指示剂反应:能使紫色石蕊溶液变蓝,能使无色酚酞溶液变红(1)与某些非金属氧化物反应:通式:碱 + 非金属氧化物 → 盐 +H2O举例:
第二部分 常见的碱1.定义:在水溶液中解离时产生的阴离子全部是氢氧根离子(或OH-)的化合物2.常见碱的特性及用途(1)氢氧化钠①化学式NaOH,俗称火碱、烧碱、苛性钠。白色固体;有强烈的腐蚀性,若沾在皮肤上,要用大量水冲洗,再涂上硼酸溶液;易溶于水,溶解时放出大量的热;易潮解,可用作某些气体的干燥剂②用途:用于生产肥皂以及石油、造纸、纺织和印染等工业;生活中用于除油污等(2)氢氧化钙①化学式Ca(OH)2,俗称熟石灰、消石灰。白色粉末状固体,微溶于水;溶解度随温度的升高而减小,有腐蚀性②用途:作建筑材料;保护树木,防止冻伤,并防止害虫生卵;用于改良酸性土壤、配制农药波尔多液等【注意】氢氧化钠、氢氧化钙易吸收空气中的CO2(或二氧化碳)而变质,因此需密封保存3.化学通性(碱4条)与指示剂反应:能使紫色石蕊溶液变蓝,能使无色酚酞溶液变红(1)与某些非金属氧化物反应:通式:碱 + 非金属氧化物 → 盐 +H2O举例:
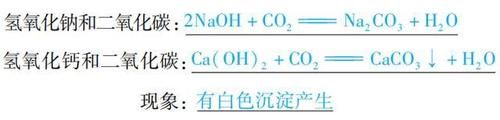 (2)与酸反应通式:酸+碱 →盐 + H2O(中和反应)(复分解反应)举例:
(2)与酸反应通式:酸+碱 →盐 + H2O(中和反应)(复分解反应)举例:
 (3)与某些盐反应通式:碱 +盐 → 新碱 +新盐(复分解反应)举例:【注意】不同碱具有“个性”的原因是含有的阳离子不同。如:练一练 1.化学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
(3)与某些盐反应通式:碱 +盐 → 新碱 +新盐(复分解反应)举例:【注意】不同碱具有“个性”的原因是含有的阳离子不同。如:练一练 1.化学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
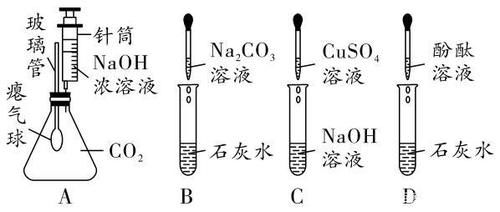 (1)实验A中,推入NaOH浓溶液后,可观察到的现象是 。(2)实验B中发生反应的化学方程式为 。实验结束后,小组同学对B试管中上层清液的溶质成分产生疑问,作出猜想:猜想一:只含有NaOH;猜想二:含有NaOH、Na2CO3;猜想三:含有NaOH、Ca(OH)2。同学们取少量B试管中的上层清液分别置于甲、乙两支试管中,进行探究:
(3)A、B、C、D四个实验中能体现碱化学通性的是 (填字母)。小组同学经过讨论认为A、B、C、D四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其他化学通性。实验的方案是 是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为:X的化学式为 。(2)为了探究NaOH样品中是否存在NaCl、Na2CO3杂质,设计如下实验方案:
(1)实验A中,推入NaOH浓溶液后,可观察到的现象是 。(2)实验B中发生反应的化学方程式为 。实验结束后,小组同学对B试管中上层清液的溶质成分产生疑问,作出猜想:猜想一:只含有NaOH;猜想二:含有NaOH、Na2CO3;猜想三:含有NaOH、Ca(OH)2。同学们取少量B试管中的上层清液分别置于甲、乙两支试管中,进行探究:
(3)A、B、C、D四个实验中能体现碱化学通性的是 (填字母)。小组同学经过讨论认为A、B、C、D四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其他化学通性。实验的方案是 是重要的化工原料,研究其制备、检验、贮存及应用具有重要意义。(1)工业上常用电解饱和食盐水的方法制取NaOH,反应的化学方程式为:X的化学式为 。(2)为了探究NaOH样品中是否存在NaCl、Na2CO3杂质,设计如下实验方案:
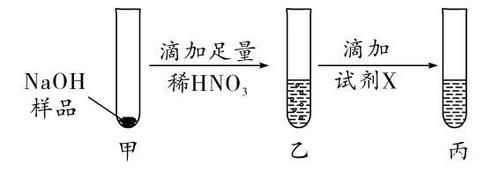 注:AgCl是白色固体,难溶于水和稀HNO3。①乙中有无色无味气体产生,证明样品中含有Na2CO3。产生气体的化学方程式为: 。②试剂X为 溶液;可证明NaCL存在的现象是丙中有白色沉淀生成。(3)某兴趣小组试图通过测定生成的CO2质量,确定因久置而变质的NaOH固体中Na2CO3的质量分数,设计了如图2所示装置并进行如下实验 :
注:AgCl是白色固体,难溶于水和稀HNO3。①乙中有无色无味气体产生,证明样品中含有Na2CO3。产生气体的化学方程式为: 。②试剂X为 溶液;可证明NaCL存在的现象是丙中有白色沉淀生成。(3)某兴趣小组试图通过测定生成的CO2质量,确定因久置而变质的NaOH固体中Na2CO3的质量分数,设计了如图2所示装置并进行如下实验 :
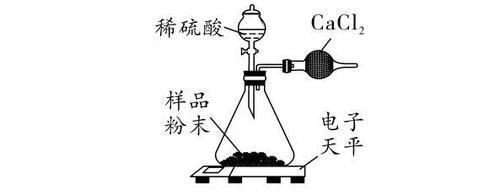






步骤一:取一定质量的样品,加入气密性良好的锥形瓶中,然后在分液漏斗中加入足量的稀硫酸,称出装置总质量为m1。步骤二:打开分液漏斗旋塞,逐滴加入稀硫酸,待气泡不再产生时,关闭旋塞,称出装置总质量为m2。①球形干燥管中不用NaOH固体而用CaCl2固体的原因是 。②小明同学认为(m1-m2)即为生成的CO2质量,小红同学认为小明的想法不合理,理由是 。(4)某工厂化验室用20%NaOH溶液洗涤一定量石油产品中残余H2SO4,共消耗NaOH溶液20g,洗涤后的溶液呈中性。这一定量石油产品中所含NaOH的质量为 。答案:1.(1)气球胀大(2)Na2CO3 +Ca(OH)2 ═ CaCO3↓ +2NaOH猜想:三;一段时间后,有气泡产生(3)ACD;向实验D反应后的溶液中逐滴滴加稀盐酸,观察到溶液红色逐渐消失(合理即可)2.(1)H2(2)①Na2CO3 + 2HNO3 ═ 2NaNO3 +H2O+CO2↑②AgNO3(或硝酸银);丙中有白色沉淀生成(3)①CaCl2不吸收CO2,而NaOH能吸收CO2②生成的CO2没有全部排出锥形瓶,导致(m1-m2)比实际生成的CO2质量偏小(4)4.9g
上一篇:2021年中考化学二轮复习第4讲-溶液的配制
下一篇:没有了




